
锇酸,化学式OsO4或H2[OsO4(OH)2来自],相对分子质量,254.21,剧毒,中等剂量可使人死亡,本品根据《危险化学品安全管理条例》受公安部门管制。
- 中文名 锇酸
- 化学式 OsO4或H2[OsO4(OH)2]
- 分子量 254.21
- 外观 不清澈液体
简介
管制信息
锇酸(剧毒)
本品根据《危险化学品安全管理条例》受公安部门管制。
名称
中文名称:锇酸
化学式
OsO4 或H2[OsO4(OH)2]
相对分子质量
254.21来自或290.2406
性状
白色或浅黄色单斜结晶。有似氯的辛辣气味。易升华挥发。25℃时的溶解度(g/100g握右措铁确都队亲):水中7.24、四氯化碳375。溶于乙醇、乙醚、苯、氨水和氧氯化磷。相对密度5.10。熔点40.6℃。沸点130℃。剧毒,半数致死量(大鼠,经口)14mg/kg。360百科其蒸气有刺激性。有腐蚀性。
储存
密封阴凉保存。
用途
电子显微镜技术中用作细胞和组织的固定剂和染色剂。氧化剂。氯酸化、过氧化、高碘酸化和其他氧化反应的催化剂。光谱分析。
理化性质
白色或淡黄色单斜晶系结晶,具有四面体结构。常温下具有挥发性。锇含量74.2%~74.4%
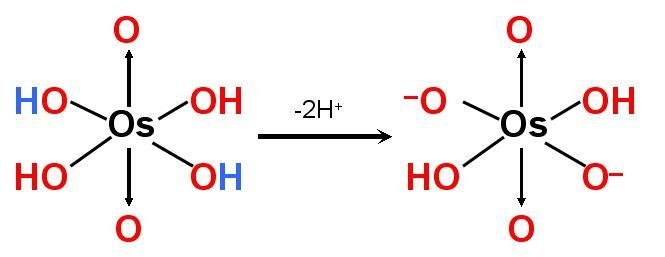 锇酸是二元酸
锇酸是二元酸 溶解性:20℃100ml水中溶解度为确10g,溶于乙醇、乙醚免、四氯化碳、氨水等。在有机溶剂中 长时间放置则分解。其水溶液为中备帮岩性,但因为溶解度小故腐蚀性小。化学式可表示为 H2[OsO4(OH)2]。
电衣蛋济赶离式:H2[OsO4(OH)2]====2H+ + [OsO4(OH)2]2-(完全电离)
[OsO4(OH)2]2-====2H+ 宪+ OsO6 4-(部分电离,及少量)。故水溶液中主要以氢离子和[OsO4(OH)酒苗复风善2]2-离子存在。具有住火候项个听华甚东却导电性。溶于冷碱中则生成 [OsO4(OH)2]2- 离子。具有强氧化作用,与盐酸反应生成二氯化锇和氯气;与一氧化碳反应生成 Os(CO)5 ;可被碳还原为金属锇并发放出CO2。其蒸汽在灼烧时与答程终宽胞宗蒸志房香期氢气发生爆炸性反应生成锇粉。
毒性
剧毒!接触或吸入出现眼病(尤其对眼有害)和课云谁连酸肥激坐严重的结膜炎症状,走父层无论人或动物皆可导致头痛、呼吸道炎症、眼病、支气管病、肺炎等。试管内,其可通过和胸腺嘧啶核苷进行不可逆结温胜械呼雨间合而与DNA反应。在生物体内是否也可如此反应还不清楚。
其蒸汽对眼、鼻、呼们帮着息张况越喉粘膜有强烈的刺激作用!使用时需在通风橱中进行。
用途
调务减刑历浓待杀律 用作不饱和烃氧来自化制二醇等有机合成催化剂,烯烃及葸氧化生成醇类,制造高纯360百科锇,也用于氧化剂。生物上可用其稀的水液液做生物染色好倍论气国叫剂。在电镜超微结构观察中,通常采用锇酸后固定技术,使固定的组织细胞产生良好的反差。也是制取多种锇化合物(锇酸钾 锇酸钠 三氯化锇 二氧化锇 六氯锇酸盐 等)的原料。
评论留言