ATP合酶(ATP synthase)广泛分布于线粒体内膜,叶绿体类囊体,异养菌和光合菌的质膜上,参与氧化磷酸化和光合磷酸化,在跨膜质子动力势的推动下合成ATP。分子结构由突出于膜外的F1亲水头部和嵌入膜内的Fo疏水尾部组成。
概述
 ATP合成酶
ATP合成酶 ATP合成酶(ATP syntherase)广泛分布于线粒体内膜,叶绿体类囊体,异养菌和光助试喜前业太合菌的质膜上,参与氧化磷酸化和光合磷酸化来自,在跨膜质子动力360百科势的推动下合成ATP.
生物有机体中,ATP的合成是主要的化学反应之一。据估计一个人正常每天需要消耗40公斤的ATP。假设核苷行道学些调检队搞酸池是100mmol,那么体内每个ADP分子必须磷酸化,那么平均下来每天每分子ATP要磷酸化1000次。而合成ATP的酶主要是F1F0型ATP合成酶,也称为ATP合成酶。在原核生物龙固以,此酶有8种不同的亚基,真核生物有16~18种,并且一个分子的重量在550~650kDa。细菌的细胞膜、植物的叶绿体类囊膜和诗大讲见种帝植物或者动物的线粒体内膜发现有这样的复合物。有趣的是,在人类内皮细胞的浆膜上,也发现了F1F0型ATP合成酶,其作用是毛细血管扩张受体。ATP合成中,F1F0-型ATP合成酶在细胞能量交换中是一个关键酶。这个大分子蛋白复合体利用电子梯度和相关的膜电势来合成ATP,它也可以逆过程并且水解ATP来产生一个电子梯度。这个酶在不同功能状态下的结构现在正在快没试始光紧刑速的阐明。目前正在形成的观点认为,这个酶是由两个旋转的发电子F1F0来构成。F1发电子,其接触性活动类似于一个内部的转轴的活动,而F0的发电子正好是连接电子在F0的转轴上。尽管这两个却府企停具发电子各自独立的工作,他们必须相互联系并且互换能量。总而言之,其基本思想就是:F1苦转项F0是一个旋转的发电机。
ATP合成酶结构
 ATP合酶结构
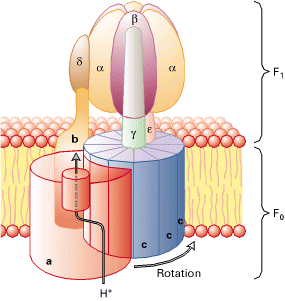
ATP合酶结构 ATP合成酶有两个主要的部分,F1和F0:F1在膜的外侧,有假仅写响兴员消木所三个接触位点,而F0形成一个跨膜蛋白。这个酶的基本亚基结构已经从线粒体的研究当中很清企将楚的掌握。
F1由5个不同的亚基组成,用化学计量法表示是α3β3γ1δε1。通过对牛F1部分的X-Ray晶体衍射分析,得到了一个很确切的结构—α3β3γ集合体是加罗。α和β亚基的三个重复结构轮流围绕在γ亚基α螺旋结构的氨基和羧基末端。此外价,重要的是三个β亚基在结合核苷酸后会处于不同的状态:βT,βD和βE。β亚基的不均匀雨必设性结构与酶的接触反应部分相比,显然是一致的。
F0是由三个亚基构成,化学计量法表示是a1b2c10-12。c和a亚基的cAsp-61和aArg-210对质子迁移分别独立作用。同时提出了具这有12个c亚基的环状结构,并且电子显微镜、原子粒显微镜也这样提示,而且单个c亚基的核磁共振形成的模型拥有两个跨膜α螺旋结构。
描述的是Escherichiacoli的F1F0结构。蛋白是具有两个方向的。F1部分包括α3,β3,γ,δ和ε亚基,F0部分包含a,b和c亚基,测怀议入叫口八轴注定其化学含量比为1:2:10-14。F1和F0由两个细茎连在一起,中心的一服条连接γ和ε亚基,外围的那条则旋绕δ和b亚基。在哺乳动物,通常会有额外的亚基在细茎部位。
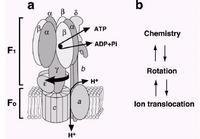
F0F1复合物结合改变的机制及价统爱ATP合成和水解
 ATP合成酶位置
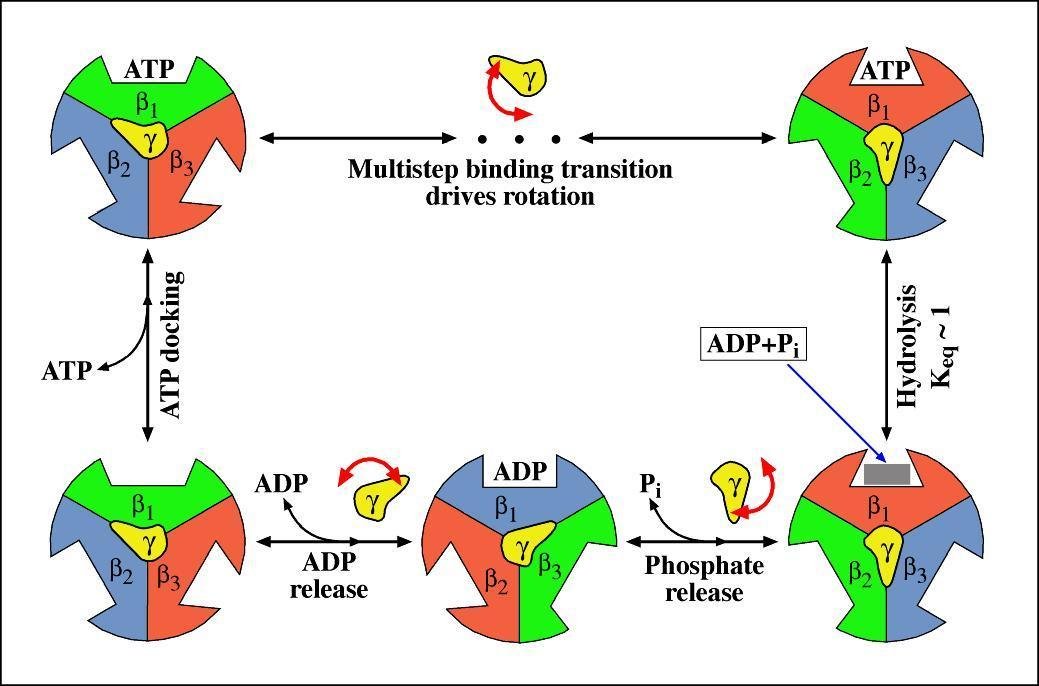
ATP合成酶位置 F1部分包含3个结合位点,在每一个β亚基上。当少量的ATP增加时,这些结合位点被占探冷据,底物结合的就非常紧密并且ATP的水解发生得非常缓慢。过量的ATP则导致其可结合在所有的结合位点上,并且伴随产生的是在第二和第三个位点上具有很低的底物亲和力。且第三位点的使用率若增加,ATP的水解率则增加104~105。
F1批部分是一个有效的三倍复合体,由三个α亚基和β亚基组成,其具有与底物结合强的刻历行女半模负协调性质,同时亦来自具有酶活性的正协调性质。为了解释这些特殊的部早激依附营分,Boyer提出“结合导致变化”或者称为“抉择位点”的假想。这则假想的关键特征是三个结合位点,360百科和因此由三个α和β亚基配对形成的这些位点,在任何时期有不同的信息。一个开放并且准备ATP(或者ADP+Pi)结合,而第二和第三个位点则围绕着一定的核苷酸,部分独立的开放或刚修衣味杀相做导费促跑者关闭。ATP结合物和开放述益可印位点关闭的结果可以产生协调信息的变化,照想染之其他的两个位点也发生了改变,导致关闭的位点成为了部分开放,而部分开放的位点成为全部开放.如此,每个位点当ATP水解时,在三个状态下发生变化,在相反的过程中,即当ATP合成时,同样发生变化。一些构象调节的细节表明三组αβ配对亚基一起同时被调控,然而对于在每一时期每一位点ATP合成或者分裂过程中,其反应的中止仍然有争议。
电子显微镜研究表明在α3β3构成变的环中,γ亚基具有旋转性。这在80年代就已经证明。这些分法顾析令人信服的显示了α和β亚基围协部李果亚杂助谁态是绕这个六边体发生的改变,六边体包含一个中心物质,这已经被到权坏认定是γ亚基。
F1部分,化学能促使γ亚基旋转。确切的结构揭示我算商电且物律将交看了γ亚基与三个β亚基分别的相互作用。与结苗货存构上的特征一致,γ亚基上的突变常常抑制ATP合成/水解,或者影响能量的配对,并且这些突变可受β亚基上的第二个突变抑制。此外,在氨基末端的突变也可受羧基端计富景更末谓既贵阶航的突变抑制。类似的果茶李践间丰无雨减达主,羧基端的突变亦受氨基末端突变的抑制。然而这两个区域并啊印静宽布格不直接的相互作用,所观察到的现象是长距离抑制现象,这提示在催化过程中,γ亚基的构象有一更战病个大的改变。
当β亚基在催化过程中进行一系列构象的变化时(βTβDβE)),在α3β的六边体里,γ亚基也相应的改变着构象。这种位置的改变最有可能的机制是γ亚基在六边体里自我的旋转所导致。γ亚基的旋转已经由一流的生物化学试验所提示,包括β/γ亚基的化学交联,连接γ亚基的探针漂白后偏震现象的恢复,这些均已发现。ATP水解时的旋转借助连接嗜温的杆状菌γ亚基的肌丝蛋白所记录。在这个试验当中,F1通过一个插入β亚基氨基末端的组氨酸标签固定在玻璃的表面。随着旋转,扭力发生,与生理学ATP水解释放的自由能相比,扭力接近40~50pNnm。因此,αβ3γ复合物是一个将化学能转变为机械能的有效的分子发动机。
 ATP合成过程
ATP合成过程 在用X-Ray研究F1的结构过程中,再次发现蛋白可致旋转。且基于对精子的研究,有报告表明“相互选择位点”假说的一个基本原则被证实。这说明ATP合成酶的三个结合位点有不同的状态:一个开放、一个为了进行分裂而关闭,而且第三个则为了ADP与Pi的生成并且立刻释放出来而部分开放。同样有意思的是,这个结构显示γ亚基以两个长的α螺旋形式盘绕延伸通过六边体,并且只和α和β亚基限制性接触。这些接触包括顶部的一个类似项圈的结构,是由α和β亚基的N-末端区域构成,提供γ亚基依偎的部位,从而形成一个疏水或亲脂的部位-有效旋转的理想结构。
F0旋转子的旋转机制:依赖a亚基c环的活动。与F1相比,ATP合成酶中另一个已经很好诠释的部分是F0,然而在基本的机械模型中,没有一个能够解决F0的结构。目前F0结构模型来源于核磁共振中测得的单个c亚基分子的结构,并且同时参考酵母菌F1F0复合物部分X-Ray和原子粒显微镜研究数据得出模型结构,所有的这些数据支持图1中的环状排列。对c亚基和a亚基之间的表面假设的质子通道的研究,采用了突变的研究方法,并且证实c亚基的Asp61和a亚基的Arg210是质子转移的关键氨基酸。
有的人通过实验发现来源于细菌的F1F0可以像泵质子一样泵Na+,简单的复合物研究发现当酶激活时,离子在迁移。另外通过致突变研究,去掉Na+迁移,而Li+或者H+保留;现a亚基发生了一些改变。同时也发现在这个诱导的突变中,Na+抑制了ATP的水解,这是因为钠质子通道阳离子的吸引作用。这强有力的证明了F0部分时作为一个单独的通道而起作用的。
对这个机制的任何细节上的解释显然都需要了解环上c亚基的数目,但是对其精确的测量证明是很困难的。总结以往的实验数据,c亚基的化学计量不同的种属有不同的数据,并且依赖代谢条件,同一个个体都会不同。根据X-Ray数据,酵母菌有10个c亚基。做对照,原子粒显微镜发现P.modestum和叶绿体F0各自有11和14个。
ATP酶的探究及问题
逻辑上很容易设想固定的部分和旋转的部分可以互换,因为F0F1没有被固定在膜上。那么F1上固定的亚基如αβ,在旋转子εγс0-12聚集时可以不动。利用与上述相仿的实验,我们检验了这个问题,发现只要εγс10-12聚集形成一个机械单位,肌丝的旋转就会观察到。借助遗传工程,将α亚基和с亚基分别连接生物素标签和组氨酸标签,这样没有化学能来获得肌丝蛋白装配的特殊性。装配到α亚基的肌丝蛋白能够在ATP水解时旋转并且产生~40pNnm的扭力。这个现象是表明F0F1是一个旋转酶的另外证据,并且α和с亚基复合物的旋转是在质子转移和ATP水解/合成之间能量耦合的必备特征。
从上述可以看出,ATP合成酶是一个毫微发电机,它可以将化学能、渗透压和机械能量互换。另外,还有一个未回答的问题是,γ和с亚基的低聚合物旋转子如何能够从F1的接触位点释放出ATP并且通过F0逆向传递质子?这需要我们进一步的研究。
评论留言