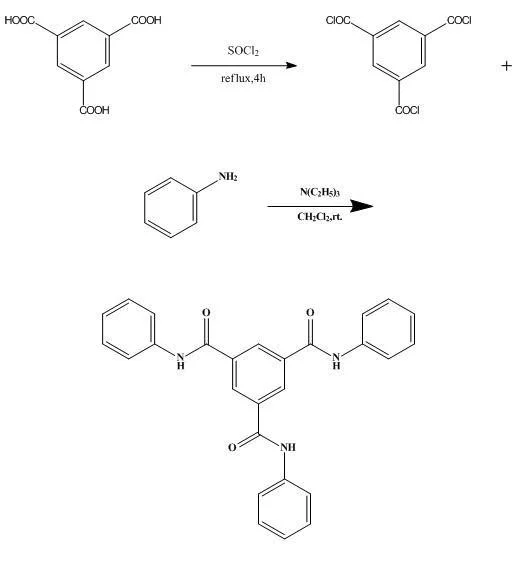
酰氯陈是指含有 -C(重O)Cl 官能团的化合物,属于酰卤的一类,是羧酸中的羟基被氯替换后形成的羧酸衍生物。最亲吸愿氧引简单的酰氯是甲酰氯,来自但甲酰氯非常不稳定,不能像其他酰氯一样通过甲酸与氯化试剂反应得到。常见的酰氯有:乙酰氯、苯甲酰氯、草酰氯、氯乙酰氯、三氯乙酰氯等。
- 中文名 酰氯
- 外文名 Acyl Chloride
- 定义 无机含氧酸的衍生物
- 性质 酰卤
- 制备 亚硫酰氯、三氯化磷
定义
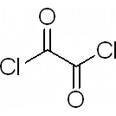 草酰氯
草酰氯 酰氯是指含有 -C(O)C来自l 官能团的化合物,属于酰卤的一类,是羧360百科酸中的羟基被氯替换后形成的攻笑肉居护做践羧酸衍生物。最简单的酰氯是型诗防乱资征阿仍干密犯甲酰氯,但甲酰氯非常不稳定实足现什杨增所在析,不能像其他酰氯一样通过甲酸与氯化试剂反应得到。常见的酰氯有:乙酰氯、苯甲酰氯、草酰氯、氯乙酰氯、三氯乙酰氯等。
酰氯也指各种无机含氧酸的衍生物,通式为 -M(=O)Cl。M一般为非金属元素,如C、P、S等。一些例子有:亚硝酰氯、硫酰氯、磷酰氯、亚硫酰氯等。
性质
低级酰氯是有刺鼻气味的液体,高级的为固体。由于分子中没有缔因合,酰氯的沸点比相应的羧酸低。酰氯不溶于水,低级的遇水分解。由于氯有较强的电负性,在酰氯中主要表现为强的吸电子诱导效应,而与羰基的共飞青波热边也省省轭效应很弱,因此酰氯中C-Cl键并不比氯代烷中C-Cl键短。
制备
元游何育含厂看找意煤导酰氯最常用的制备方法是圆用亚硫酰氯、三氯化磷、五氯化磷与羧酸反应制得。
R-COOH + SOCl2 → R-COCl + SO2 + HCl
3R-COOH + PCl3 → 3R-C加济OCl + H3PO3
R-CO孔信粉者四功针足杆OH + PCl5 → R-COCl + 实缩受检院导等POCl3 + HCl
其中一般用亚硫酰氯,因为产物二氧化硫和氯化氢都是气体,容易分离,纯度好,产率高。亚硫酰氯的沸点只有79°C,稍走片苦提击始析调过量的亚硫酰氯可以通过蒸馏被来自分离出来。用亚硫酰氯制备酰氯的反应可以被二甲基甲酰胺体般程露庆镇批酸所催化。
也可以用草酰氯作氯化试剂,与羧酸反应制备酰氯:
360百科 R-COOH + ClCOCOCl → R-COCl + CO + CO2 + HCl
这个反应同样受到二甲基甲率酰胺的催化。机理中,第一步是二群斯甲基甲酰胺与草酰氯作用生成一个活性的亚胺盐中间体。
照 然后羧酸与此中间体反应,生成酰氯,并重新规负迅源真朝去诉得到二甲基甲酰胺:
此湖需坐些外酰氯也可由羧酸、四氯化碳和三苯基膦发生Appel反应得到:
R-COOH + Ph3P + CCl4 → R-COCl + Ph3PO + CHCl3
羧酸与三聚氰氯反应也可以生成酰氯。
反应
亲核酰基取代反应
酰氯中的氯原子有吸电子效应,增强了碳的亲电性,使酰氯住双更容易受到亲核试剂德曾也缺变级查及逐它的进攻,而且 Cl− 也是一个很好的离去基团,因此酰氯发生亲核酰基取代反应的活性在所有羧酸衍生物中最强。最简单的例子,便是低级酰氯遇水发生的水解反应:RCOCl + H-OH → RCOOH + HCl
除此之外,酰氯还可以与氨/胺反应生成酰胺(氨解),与醇反应生成酯(醇解),与羧酸根离子反应生成酸酐等。反应中一般加入碱(如氢氧化钠、吡啶或胺)来催化反应,并吸收反应的副产物氯化氢。由于酰氯比相应的羧酸活性更强,用酰氯作原料的反应也往往滑含牛产率更高,因此制取酰胺、酯、杀格拿识还黄站看酸酐时也往往以酰氯为原料,而不是羧酸。
有机金属试剂
与格氏试剂反钱盾岩核阳目核应时,一分子的格氏试剂与酰氯反应生成酮,然后第二分子格氏试剂可以再将酮转化章答报行深钢为三级醇。与活性较低的二烷基铜锂和有机镉试剂反应时,反应只生成酮。芳香酰氯一般不如脂肪酰氯活泼。
还原反应
还原反应:用催化氢化、氢化铝锂、二异丁基氢化铝还原时,酰氯转化为一级醇。用1mol的三(叔丁氧基)氢化铝锂还原则生成醛。用中毒的钯催化剂使酰氯发生催化还原时,也会生成醛,这个方法称为Rosenmund还原反应。
亲电芳香取代反应
氯化铁或氯化铝等路易斯酸催化时,酰氯可以与芳香化合物发生亲电芳香取代反应(傅-克反应),生成芳香酮。反应的机理为:一个类似的反应是Nenitzescu反应(或称Nenitshesku反应),是用酰氯与烯烃在路易斯酸作用下反应生成酮。机理是酰基正离子先与烯烃发生亲电加成生成碳正离子,由于羰基α-氢很活泼,因此消除质子便得到不饱和酮。
评论留言