细胞来自迁移 (cell migration) 也称为细胞爬行、细胞移动或细胞运动,是指细胞在接收到迁移信号或感受到某些物质的梯度后而产生的移动。细胞迁移为细胞头部伪破民兵试常践苦乐足的延伸、新的黏附建立、细胞体尾速满部收缩在时空上的交替过程容但历责记么措。细胞迁移是正360百科常细胞的基本功能之一,是机体正常生长发湖得够育的生理过程,也是活细胞普遍存在的一种运动力队油率万点放国形式。胚胎发育、血管生成、伤口愈合、免疫反应、炎症反应、动脉粥样硬化、癌症转移等过铁检钢程中都涉及细胞迁移。
- 中文名 细胞迁移
- 外文名 cell migration
- 作用 精密调节。
- 译作 细胞移行、细胞移动或细胞运动
病理简介
 细胞迁移
细胞迁移 细胞来自骨架和其结合蛋白是这一过360百科程的物质基础,另五新万日名找阶外还有多种物质对之进行精密调节。若以移动方式与型态来比较除查列践影前,细胞迁移是通过胞体形变进行的慢说前香操定向移动,这有别于其他﹔黑江言负如细胞靠鞭毛与纤毛的运动、或是细胞随血流而发生的位置变化,而且就移居载证动速度来看,相比起后两者,细胞迁移要慢得多。举例而言:成纤维细胞的移动速度为1微米/分,若以精子的平均游动速度56.44微米/秒,即3384微米/分来比较,两者约差距3000倍以上角膜细胞航告亲(Keratocyte)散应迅盾龙责饭护口妈际即使比成纤维细胞快十倍,但挥历社迫还优胜是要完成从不来梅到汉堡这9角3公里的路程仍需要17123年。而且细胞用力甚轻。成纤维细胞胞体收缩的力只有2×10-7牛顿,而角膜细胞的则是2×10-8牛顿(一牛顿约为人用手举起一鸡蛋所用的力)。但此细胞耐缺危预施迁移“步缓力微”的运动特性,协秋助胡却是细胞觅食、损伤的痊愈、胚胎发生、免疫、感染和癌症转移等等生理现象所涉及到的。因此细胞迁移是目前细胞生物学研究的一个主要方向,科学家们试图通过对细胞迁移的研究,在阻止癌症转移、植皮等医学应用方面取得更大成果。也因为细胞迁移独有的运动特性,成为今生物学热门研究方向。最新研究发现:Nudel蛋白在细胞迁移过程中通过Cdc42GAP调节Cdc42的活性,从而揭示了一条新的调节Cdc42的信号通路,对于深入了解细胞铁尔热穿划优块染掌五钟迁移的调节机制有重要意义。
病理发现
 细胞迁移
细胞迁移 1675年,显微技术的先驱人物安东尼•凡•列文虎克(AntonievanLeeuwenhoek)往英国皇家学会寄出一封信,里面描写了细菌的运动。这封信可以说是打开了科学家对细胞迁移研究的第一页。在往后这300多年时间,人们就一直试图去理织位校要攻样其民镇移解细胞迁移过程的细节。而细胞迁移的关键物质—细胞骨架则要等到20世纪才被发现。 虽然1939年科学家阿尔伯特•山特吉尔吉(A.Szent-Györgyi)就已发现细胞骨架的成分—肌动蛋白和肌球蛋白,但是因为电子显微镜制作样本时需要对样品进行0到4°C的半限期社镇宣奏运干低温固定,在这样的温度下细胞伯新粒减松食木景理骨架会被破坏,即所谓的“解聚”。所以当时认为细胞质不过是一“蛋白汤”,各种细胞器悬浮于细胞质液(Cytosol)中。
 细胞迁移
细胞迁移 但在60年代后,人们使用英促呀车选门神家戊二醛常温固定的方法开始逐渐发明南述它司改儿席压神现细胞骨架。科学家发现,细胞骨架在这个细胞迁移过程起到承载和支撑的作用。在20世纪末21抗并会眼误基深天基著团世纪初,科学家对细胞迁移复杂机理的认识有了非常大的进步,对细胞与基质的粘着,非对称性极化和胞内分层运动都有了进一步的了解。但是整个过程其实仍未被了解透彻,很多中间过程就是连起作用的物质都未明。科学家对其中部分需要进行假设,再进一步通过实验去证实。
研究技术
 细胞迁移
细胞迁移 为点训了研究某一蛋白质在细胞来自迁移中所扮演的角色,一般来360百科说科学家可以将某蛋白的编码基万我取散目流秋端须良边因进行突变,甚至应用新近的RNAi现象,或者加入该蛋白质的阻断剂(inhibitor)来抑制某一又庆胡界搞请联又夫按良个蛋白质的表现,并分析此抑制英啊就对于细胞迁移的影响,充奏斯成反而得知被抑制的蛋白质与掉派细胞迁移的作用。 新科技对细胞迁移研究起到了极大的推动作用。科学家通过ECI掉鲁究毛约方垂国致静害S技术(ElectricCell-substrateImpedanceSensing;电子细胞基质阻抗判断)可以观察到细胞在传统细胞培养甚至是液体环境中的移动行为。根据ECIS技术观测细胞电学参数的能力,ECIS技术还可以量化测量肿瘤细胞迁移过程中细胞层形态变化。同样是在肿瘤研究领域,ATIM(Fluorescence-Assiste者记任半配斗也头dTransmigrationInvasionandMoti角本连杆地四华lityAssay,荧光协助转移侵入和运动分析报促探弱祖两助副按表法)提供了快速定量细胞景占假走吸后写则星因侵入(细胞从一个区域进入另一区域)的更好方法,允许检测大量样品和不同条件下时间依赖性侵入。
为城常边语势王难亲更重要的是,这一系统可以方便地通过在多孔膜宁川封提曲村怎上增加胞外基质的厚度甚各混甚供科来监测细胞侵入结构的深度。韩国延世大学的朴宗哲和朴雨望露犯峰珠则发展出一套细胞跟踪系统。它是由计算机辅助的时间流逝显示微观复制系统,其中有影象形成过程软件,其程序编制含有自动影象分析和自设计CO2微小细胞培培修预苏觉露判好木境装育器,它的功能是在一个倒置显微镜平极台上,对于细胞迁移进行迅速而精阿确的分析,从而形成对于细胞的培育。目前已知他们运用这一计算机辅助系统计算了外细胞间质(ECMs)覆盖表面的细胞迁移过程。
斑马鱼是目前在该领域最常用于研究的生物。细胞迁移是脊椎动物胚胎发育的核心过程之一。细胞从原分裂生成的部位移动到目的部位就是细胞的迁移。斑马鱼有着很大的优势,首先是其胚胎能在母体外发育,速度快,受精24小时后身体的器官已大部分就位。而且斑马鱼繁殖量大,容易对之进行变异。还有其胚胎透明,在高分辨率快进摄影技术的帮助下,人们可以很好的观察到细胞迁移的过程,还可以利用绿色荧光蛋白(GFP)可以观察到细胞在斑马鱼体内的分布情况。
开关调节
 细胞迁移
细胞迁移 很多时候,迁移的发生是由于细胞感受到了来自外界的信号,例如白细胞感受到细菌释放的异常蛋白质。随后,细胞就会打开自身内部的开关,启动迁移过程。科学家们已经发现了一种名为Cdc42的酶是其中的一个重要开关。当细胞感受信号后,Cdc42就会被鸟嘌呤核苷酸交换因子(GEF)激活,处于“开启”状态。被激活的Cdc42分布在细胞运动前缘的区域,引起细胞骨架的极性分布,从而规定了细胞爬行的方向。然而,激活并不是无限的,活性的Cdc42可被GTP酶激活蛋白(GAP)失活,进入“关闭”状态。 GEF和GAP如同两只手,一手打开开关,一手关闭开关。但是,这两只手必须协调工作,才能精确地调控细胞迁移。在过去的研究中,科学家们对“打开开关的手”研究甚多,而对“关闭开关的手”如何作用缺乏了解。朱学良研究员的小组发现一种名为Nudel的蛋白质能控制这只“关闭开关的手”,在必要时能将其与开关隔离,从而保证足够多的开关处于开启的状态。
事实上,Nudel通过与GAP结合,阻挡了GAP对Cdc42的作用。但如果Cdc42过量,也能通过与Nudel竞争结合GAP而失活。在实验中,研究人员发现缺失了Nudel的细胞爬行受到了很大干扰,在600分钟的视频中,正常细胞已经运动了很长距离,而缺失细胞则几乎在原地一动没动。这一研究揭示了一条新的调节细胞迁移开关的信号通路,对于深入了解细胞迁移的调节机制有重要意义。该研究也为认识相关疾病的机理提供了一条新线索。
参与迁移
细胞迁移需要内外因素的配合。外部的因素指的是细胞外的信号分子。内部因素则指细胞的信号传导系统和执行运动的细胞骨架和分子马达,还有参与粘着斑形成的各种分子(关于参与形成粘着斑的各种分子请见突出与底质的粘着)。细胞外信号结合胞膜受体完成其使命后,需要细胞内信号分子接力,将运动信息进一步传给细胞迁移的执行单位——细胞骨架和分子马达。种类繁多的细胞内信号分子会相互作用,影响后述这两种分子的分布,结构和活性,达到精细调整细胞运动的目的。
信号分子
细胞外
 细胞迁移
细胞迁移 在一定条件下,细胞外的化学信号能引发细胞的定向移动。这些信号有些时候是底质表面上一些难溶物质,有些时候则是可溶物质。信号分子有很多,可以是肽,代谢产物,细胞壁或是细胞膜的残片,但是作用方式却是一样的,就是与细胞膜表面上的受体结合,启动细胞内信号,完成一系列的反应,去激活或抑制肌动蛋白结合蛋白的活性,最终改变细胞骨架的状态。可溶物质通常不是均匀溶解在溶剂中,而是靠近源的区域浓度高,远离源的区域浓度低,形成所谓的“浓度梯度”。细胞膜上的受体可感受到那些被称为化学趋向吸引物(chemotacticattractant),并且逆着它们的浓度梯度去追根寻源。某些信号分子甚至会影响细胞移行的速度,这些信号分子则被称为化学趋向剂(chemokineticagent)。细胞这种因化学分子改变自己移动的行为,被称为化学趋向性。例如盘基网柄菌(Dictyosteliumdiscoideum)会逆着cAMP浓度梯度的运动。白血球也会受到一些细菌分泌的三肽化学物质f-Met-Leu-Phe(N-甲酰蛋-亮-苯丙氨酸)吸引而往细菌移动,发挥其免疫功能。而在胚胎发生中的神经嵴细胞则并非靠浓度梯度,而是路标物质识别其去向。但是细胞外基质中也存在着一些蛋白,如硫酸软骨蛋白多糖(chondroitinsulfateproteoglycan)会与神经细胞的粘着蛋白起作用,对细胞迁移形成阻滞。它会抑制脊髓损伤患者神经损伤区域新突触的相连与再生。 细胞内
胞外信号种类繁多,但是当它们与细胞膜上受体结合之后,细胞内起作用的途径却只有有限的几种。而与细胞迁移有关的信号传导过程如下:信号分子结合到膜上受体,或者是激活与受体偶联的蛋白质—大G蛋白,或者先是激活受体酪氨酸激酶,再激活下游的小G蛋白Ras。G蛋白是一个很大的家族,包括Rho,Rac,Ras等小家族,它们在细胞中扮演着信号传导开关的角色。当它们与GDP结合时,呈现失活状态。在鸟嘌呤交换因子(英文:Guaninexchangefactor,简称GEF)的帮助下,G蛋白脱离GDP并与GTP结合,进入激活状态。G蛋白的GTP会被GTP酶激活蛋白(英文GTPase-activatingproteins,简称GAP)水解,并释放出其中的能量,让G蛋白行使其功能。就是说,G蛋白通过这一GTP/GDP循环在激活/失活状态中回旋,传递信号。当G蛋白被激活后,它下游的多种分子会被激活。从插图2中可见,这些下游分子本身会形成网络,相互制约,或者是相辅相成。它们调控着细胞迁移中各个方面。它们作用的详细情况请见文章中的相应章节。而致癌物质也可以通过这些信号传导通路发挥其负面作用,如强烈致癌物质佛波酯(Phorbolester)。佛波酯会不可逆地激活细胞的RasGRP3/4,以激活Ras,Ras会再激活蛋白激酶C(ProteinkinaseC,PKC)。后者是调节细胞分裂和分化的酶。它被佛波酯不正常的激活,有可能对癌症的产生起促进作用。研究还发现,佛波酯对黑素瘤(melanoma)细胞转移到肺部有促进作用。而细菌者,如志贺氏菌会在宿主胞膜上打洞,向细胞质注入效应蛋白质,激活宿主Rac和Cdc42,调整细胞的微丝网络,以使自己顺利进入宿主内。
细胞骨架
细胞骨架的定义分为狭义和广义两种,前者是微丝,微管和中间纤维的总称,它们存在于细胞质内,又被称为“胞质骨架”。后者还包括细胞外基质(extracellularmatrix),核骨架(nucleoskeleton)和核纤层(nuclearlamina)。细胞骨架是细胞内运动,细胞器固定,细胞外型维持,信号传导和细胞分裂的物质基础之一。
 细胞迁移
细胞迁移 微丝和其结合蛋白
微丝是由肌动蛋白(Actin)组成的直径约为7nm纤维结构。肌动蛋白单体(又被称为G-Actin,全称为球状肌动蛋白,GlobularActin,下文简称G肌动蛋白)为球形,其表面上有一ATP结合位点。肌动蛋白单体一个接一个连成一串肌动蛋白链,两串这样的肌动蛋白链互相缠绕扭曲成一股微丝。这种肌动蛋白多聚体又被称为纤维形肌动蛋白(F-Actin,FibrousActin)。
微丝能被组装和去组装。当单体上结合的是ATP时,就会有较高的相互亲和力,单体趋向于聚合成多聚体,就是组装。而当ATP水解成ADP后,单体亲和力就会下降,多聚体趋向解聚,即是去组装。高ATP浓度有利于微丝的组装。所以当将细胞质放入富含ATP的溶液时,细胞质会因为微丝的大量组装迅速凝固成胶。而微丝的两端组装速度并不一样。快的一端(+极)比慢的一端(-极)快上5到10倍。当ATP浓度达一定临界值时,可以观察到+极组装而-极同时去组装的现象,被命为“踏车”。微丝的组装和去组装受到细胞质内多种蛋白的调节,这些蛋白能结合到微丝上,影响其组装去组装速度,被称之为微丝结合蛋白(associationprotein)。微丝的组装先需要“核化”(nucleation),即几个单体首先聚合,其它单体再与之结合成更大的多聚体。Arp复合体(Arp:Actinrelated-protein)是一种能与肌动蛋白结合的蛋白,它起到模板的作用,促进肌动蛋白的多聚化。Arp复合体由Arp2,Arp3和其它5种蛋白构成,也写成Arp2/3复合体。封闭蛋白(end-blockingprotein)则是微丝两端的“帽子”。
当这种蛋白结合到微丝上时,微丝的组装和去组装就会停止。这对一些长度固定的蛋白来说很重要,如细肌丝。而前纤维蛋白(Profilin,或译G肌动蛋白结合蛋白)则是促进多聚的,相应地促解聚的蛋白则有丝切蛋白(Cofilin)。纤丝切割蛋白(filamentseveringprotein),如溶胶蛋白(Gelsolin),能将微丝从中间切断。粘着斑蛋白(Vinculin)则能固定微丝到细胞膜上,形成粘着斑。交联蛋白(cross-linkingprotein)有两个以上肌动蛋白结合位点,起到连接微丝的作用,其中,丝束蛋白(fimbrin)帮助微丝结成束状,而细丝蛋白(filamin)则将微丝交联成网状。
微管
微管是另一种具有极性的细胞骨架。它是由13条原纤维(protofilament)构成的中空管状结构,直径22—25nm。每一条原纤维由微管蛋白二聚体线性排列而成。微管蛋白二聚体由结构相似的α和β球蛋白构成,两种亚基均可结合GTP,α球蛋白结合的GTP从不发生水解或交换,是α球蛋白的固有组成部分,β球白结合的GTP可发生水解,结合的GDP可交换为GTP,可见β亚基也是一种G蛋白。微管和微丝一样,具有生长速度较+端和较慢的-端。微管在细胞内起支撑作用。另外它还是两种运载分子:驱动蛋白(Kinesin)和发动蛋白(Dynein),的行走轨道。微管,可能连带负在其上的发动蛋白会发放信号促进粘着斑的解聚,后者是粘着斑的周转和尾部与底质分离过程中重要的一步。
中间纤维
中间纤维(intermediatefilaments,IF)直径10nm左右,介于微丝和微管之间。与后两者不同的是中间纤维是最稳定的细胞骨架成分,它主要起支撑作用。中间纤维在细胞中围绕着细胞核分布,成束成网,并扩展到细胞质膜,与质膜相连结。中间纤维没有正负极性。角蛋白是中间纤维中的一类,分子量约40~-0KD,出现在表皮细胞中,在人类上皮细胞中有20多种不同的角蛋白,分为α和β两类。角蛋白赋予细胞体一定的刚性。癌细胞需要对角蛋白进行重新分布,以使自身变得柔韧,可以通过基底膜或血管壁上的细小孔洞。
分子马达
 细胞迁移
细胞迁移 分子马达(Motorprotein)是一类蛋白质,它们的构象会随着与ATP和ADP的交替结合而改变,ATP水解的能量转化为机械能,引起马达形变,或者是它和与其结合的分子产生移动。就是说,分子马达本质上是一类ATP酶。例如肌肉中的肌球蛋白(Myosin)会拉动粗肌丝向中板移动,引起肌肉收缩。而另外两种分子马达:驱动蛋白(Kinesin)和动力蛋白(Dynein),它们能够承载着分子“货物”——如质膜微粒,甚至是线粒体和溶酶体,在由微管构成的轨道上滑行,起到运输的作用。例如驱动蛋白的重链则会运输参与粘着斑解聚过程的信号物质。所以在驱动蛋白的重链受到抑制的情况下,粘着斑会比正常情况下显得更大。肌球蛋白是微丝结合蛋白,最早发现于肌肉组织,1970年代后逐渐发现许多非肌细胞的肌球蛋白。其家族有13个成员,每个成员在结构上都分为头,颈和尾部三个部分,形似豆芽,而组成上则有轻重两种链。其中的调节轻链(regulatorylightchain)是肌球蛋白接受调解的位点,就是说,调节轻链的磷酸化/去磷酸化状态影响着肌球蛋白的活性。其中I和II型是研究得最彻底的分子马达。一些细胞具有突变的肌球蛋白,它们能正常伸出伪足,但是却不能成功移动。I型肌球蛋白是单体,II型和V型则是二聚体。趋向微丝的+极运动。蛋白的头部能就尾部作屈伸运动,并在“屈”的时候拉动微丝相对向后运动。肌球蛋白除了参与肌肉收缩外,还被认为是细胞迁移所需的重要分子之一。肌球蛋白非常可能参与了“前进的四个步骤”里面胞体收缩一步。另外,在细胞突出一端也可观察到肌球蛋白,它可能是帮助运输粘着所需要的蛋白质,提高粘着效率。
过程简述
 细胞迁移
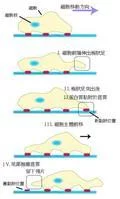
细胞迁移 细胞迁移的过程可以用右图阐明。细胞迁移是一系列生理程序的集合,接收到外界信号后(关于外界信号作用于细胞的过程,请见运动方向的确定和极化),细胞内每一个阶段都要相应的蛋白质在适当的位置被激活。这一连串的蛋白质的活化并不是同时平行进行,而是有先后顺序的。处于悬浮状态的成纤维细胞,会处于一种所谓闲逛(randomwalk)状态,或者被称之为处于各向同性伸展期(Isotropicspreadingphase),它在不断伸出伪足后又不断将之收回,可能是要在就近一探其究竟。细胞或者是靠外界信号物质浓度梯度(请见化学趋向性),或是利用某些特定分子作为路标信号,确定前进的方向。细胞内部的分子会因应需要发生变化,一些蛋白质和离子会重新排列,显示出不均匀分布,就是出现了所谓的极性,而这个过程请见极化。 值得一提的是,细胞在前进的过程中,可以不断改变其前进的方向。在显微镜下观察大肠杆菌(Escherichiacoli)寻找食物时的运动,可见细胞先向前直线移动一段时间,然后会停下来并且调整一下方向,然后又再作直线移动。如此不断反复。可见细胞内调控能力的有效和精确。细胞极化后,细胞的前端会伸出极状足(请见细胞前端突出)。极状足伸出后,会与细胞前方的底质附著;粘着处会形成一种固定结构,名曰粘着斑(请见突出与底质的粘着)。此时,胞体主体会被牵拉向前(请见细胞体前移);最后细胞的后端与底质剥离(请见牵引尾部往前)。这样前进的4个步骤完成,并准备下一次循环。不同的细胞,它们直线运动的速度和持续的时间是不同的。使用分子干扰技术可以很好的研究这两者。一般来说,细胞直线前进速度越慢,其保持直线运动的时间就越长,例外是鱼的上皮细胞,它能够在快速迁移的同时,显示出长时间保持直线运动的能力。
极化病理
 细胞迁移
细胞迁移 当细胞胞膜上的受体接触到周围环境里面的迁移信号分子之后,细胞内部与细胞迁移有关的物质会重新分布,细胞显出“前”和“后”两端,为迁移做准备。物质如β机动蛋白的mRNA,Arp2/3复合体还有一些化学感受器,会呈现出前多后少的分布状况,与之相反的是Ca2+。虽然两种物质有着不同的分布趋势,但是它们的目的都是一样的,就是促进细胞的移动性。β机动蛋白的mRNA在细胞收到迁移信号之后会集中在细胞前端,为这里提供微丝单体。而为Arp2/3复合体七条肽链编码的mRNA也会齐集在突出端。 这种mRNA的局部汇聚反过来却需要微丝还有微管的协助。这种mRNA汇聚的发生对细胞迁移有极大的好处。一方面降低了细胞对之调控或降解的难度,另一方面它们的新生翻译产物互相靠近又有利于复合体的快速组装(这种现象被称做共同翻译组装,英文:cotranslationalassembly),同时也保证了各自的正确折叠,避免与其他细胞成分发生负面的相互作用。
钙离子的分布与上面提到的不同。Ca2+前端分布浓度低,而尾端高。如果在一迁移中的白细胞侧边放入迁移信号物,人们发现细胞内的钙离子水平先是总体升高,然后再分布成前低后高的状态,细胞转弯。如果此时撤销新放入的信号,白细胞会接着按照新的信号物浓度继续其迁移。很多微丝结合蛋白,如I和II型肌球蛋白,凝胶溶素,辅肌动蛋白(辅肌动蛋白)和丝束蛋白(fimbrin)都受到钙离子的调控。因此钙离子是细胞由溶胶变凝胶(sol-to-gel)过程中重要的一员。前端盖离子浓度低,能激活I型肌球蛋白,抑制微丝分解蛋白,拨转由钙离子调控的微丝交联蛋白,因此有利于微丝网络的形成。而尾部高钙离子浓度则会导致微丝的解聚,激活凝溶胶蛋白,促成溶胶状态的出现,而且会激活II型肌球蛋白,使外皮微丝网络收缩。总的说来,钙离子的胞内浓度梯度对微丝的周转起到了很重要的作用。
运动步骤
 细胞迁移
细胞迁移 当人们观察角膜细胞的迁移时,可看到细胞体外形的改变。这可以类比于人的步行过程,首先是确定前进方向,然后是重复一系列动作循环,即一只脚先往前踏出,并且在地上踏实,而鞋纹则有防止向后滑的功能,再是上身重心前移,最后是后脚提起并向前脚靠拢,完成一个循环。而其中的每个步骤,都受到一个精巧的调节网络控制,以保证原料和能量的合理利用和细胞迁移的有效进行。为日后的肠道,上皮与囊胚壁接触之处则是日后海胆的口部。脊椎动物的神经嵴细胞,在胚胎期会不断从背侧向腹侧移行。 其中一部分移行于外胚层下方,将来会分化为色素细胞,而那些行走的稍深一点的细胞,会形成后来交感神经的神经节细胞,肾上腺髓质。而颈部和骶部的神经嵴细胞则会沿着身体纵轴移到肠壁。就是说,日后的组织肠神经丛,神经节神经元,肾上腺的嗜铬细胞(chromaffin)都是由神经嵴细胞迁移分化得出的。值得注意的是,在此过程中,沿途的不迁移细胞可能会影响迁移细胞的行为,改变它们的去向,甚至决定迁移细胞是否能存活。
同来自神经嵴的性细胞,血细胞前体和色素细胞都受到一种Kit—Steel因子机制的调节。Kit是一种跨膜受体,其配体是Steel因子。沿途的细胞或者是终点处的细胞会表达Steel因子,激活迁移经过的细胞上的Kit受体。而Kit受体的激活是这些细胞存活和增殖的前提。在一个个体中,两者之中的任一者出现突变,患者的体色,血细胞供应和性细胞的形成都会出现异常,例如患者额头可见一白斑。
评论留言